- Termofísica
- /
- Termodinâmica
- /
- Seg. Lei da Termodinâmica
"A máquina perfeita (moto-contínuo), que reutilizariam indefinidamente a energia gerada por seu próprio movimento, é inatingível."
Segunda Lei da Termodinâmica
Todos os processos conhecidos que ocorrem na natureza, sejam mecânicos, elétricos, químicos ou biológicos obedecem as leis da termodinâmica. Ela é muito importante para a engenharia, para a construção de máquinas e a questão da geração e utilização da energia. Neste contexto as seguintes definições são importantes:
- Equilíbrio termodinâmico
- é quando um sistema está em equilíbrio térmico, mecânico, radiativo e químico. Nesse caso, não há troca de matéria ou de energia entre o sistema e as vizinhaças, não há mudanças de fase e não há potenciais elétricos desequilibrados dentro do sistema.
- Processos reversíveis
- Um processo será reversível se um sistema passar de um estado inicial de equilíbrio para um estado final de equilíbrio através de uma sucessão de estados de equilíbrio termodinâmico. Se um processo real ocorre muito lentamente (quase-estaticamente), isto é, com tamanha lentidão que cada etapa só tenha uma diferença minúscula (infinitesimal) em relação a etapa de equilíbrio anterior, o processo pode ser considerado reversível. Caso contrário, o processo é dito irreversível.
- Processos espontâneos
- Existem processos espontâneos e não espontâneos. Por exemplo, o calor passa espontaneamente do corpo quente para o mais frio, dois gases em um mesmo recipiente se misturam espontaneamente. Porém, há os processos não espontâneos, onde é preciso realizar trabalho para que eles ocorram, como é o caso quando desejamos passar o calor de um corpo mais frio para um mais quente ou para separar uma mistura de gases.
- Máquinas térmicas
- são dispositivo que transforma energia térmica em outras formas de energia. Exemplos de máquinas térmicas são: Máquina a vapor (mais antiga), máquinas a vapor alternativas (pistão, como a Maria Fumaça), motores a combustão (diesel e Otto), máquinas a reação (turbina a jato e armas de fogo) e etc. As máquinas térmicas utilizam um fluido operante, o qual retira calor de uma fonte quente e parte dessa quantidade de calor é efetivamente utilizada na realização de trabalho, o restante do calor é rejeitado para uma fonte fria (vide figura). Assim temos que: $$ W = Q_q - Q_f.$$
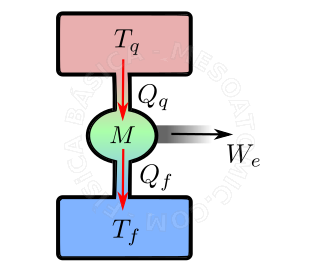
Diagrama de uma máquina térmica. Uma substância, em geral um gás, é aquecido pela fonte quente (retângulo vermelho), depois esta substância realiza um trabalho externo \(W_e\) (bola verde), levanta algum peso ao se expandir, por exemplo. Depois a substância é arrefecida (esfriada) e comprimida (retângulo azul). E em seguida é aquecida, e o ciclo se inicia novamente. - Rendimento
- O rendimento \(\eta\) de uma máquina térmica é a razão entre o trabalho realizado e a quantidade de calor retirada da fonte quente: $$\eta = \frac{W}{Q_q}= \frac{Q_q – Q_f}{Q_q} = 1 - \frac{Q_f}{Q_q}.$$
Enunciados da 2ª lei e consequências
Apresentaremos a 2ª lei de três formas diferentes, pois consideramos que cada enunciado realça um aspecto importante.
- Enunciado da Eficiência (Kelvin)
- Nenhum processo é possível cujo único resultado é a conversão completa de calor em trabalho.
- Enunciado da Irreversibilidade (Clausius)
- Nenhum processo é possível cujo único resultado é a transferência de calor de um corpo quente para outro mais quente.
- Enunciado da entropia
- Todos os processos naturais evoluem na direção que leva ao aumento da entropia. (De forma simplificada, entropia pode ser entendida como uma medida de desordem das partículas do sistema.)
- Rendimento máximo (máquina de Carnot)
- A máquina de Carnot é uma máquina térmica teórica de rendimento máximo. Isto é, nenhuma máquina térmica operando entre duas fontes pode ser mais eficiente que esta máquina operando entre os mesmos dois reservatórios térmicos. O rendimento do ciclo de Carnot é: $$ \eta_c = 1 - \frac{T_f}{T_q},$$ onde \(T_f\) e \(T_q\) são as temperaturas das fontes frias e quentes, respectivamente, em Kenvin.
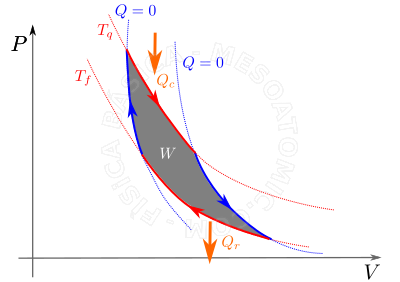
Ciclo de Carnot. Primeiro ocorre uma expansão isotérmica reversível (linha vermelha superior), onde a fonte quente cede uma quantidade de calor \(Q_c\) ao sistema. Depois ocorre uma expansão adiabática reversível (linha azul da direita), e o sistema não troca calor com as fontes térmicas. Em seguida, acontece uma compressão isotérmica reversível (linha vermelha inferior), e o sistema rejeita uma quantidade de calor \(Q_r\) para a fonte fria. Por fim, ocorre uma compressão adiabática reversível (linha azul da esquerda), onde o sistema não troca calor com as fontes térmicas. - Refrigerador de Carnot.
- Os refrigeradores são máquinas frigoríficas que transferem calor ( \(Q_f\) ) de um sistema em menor temperatura (congelador) para o meio exterior, que se encontra a uma temperatura mais alta \((Q_q)\) . Tal passagem não é espontânea, ocorrendo à custa de um trabalho (W) externo (trabalho do compressor). O coeficiente de performance \(K_p\) é definido por: $$K_p = \frac{∣Q_f∣}{|W∣} = \frac{∣Q_f∣}{∣Q_q∣ - ∣Q_f∣}$$
- Entropia e a 2ª lei
- A entropia \(S\) , assim como a pressão, o volume e outras grandezas, é uma característica de um sistema em equilíbrio. A 2ª lei da termodinâmica afirma que "em qualquer processo termodinâmico que evolui, de um estado de equilíbrio para outro, a entropia do conjunto sistema+vizinhança ou permanece constante ou aumenta". A variação de entropia de um sistema que sofre um processo real (irreversível) entre dois estados de equilíbrio é, no mínimo, igual a variação de entropia num processo reversível entre os mesmos estados.
- Cálculo da Variação de Entropia num Processo Isotérmico.
- $$\Delta S = \frac{\Delta Q}{T}$$
- $$U(S) = \frac{J}{K} ~~(S.I.)$$
- \(\Delta Q\) = quantidade de calor trocado pelo sistema com o exterior.
- \(T\) = temperatura na qual ocorre essa troca.
- A variação de entropia de um sistema é positiva quando a quantidade de calor \(\Delta Q\) é positiva, isto é, quando o sistema recebe calor, e negativa quando o sistema fornece calor.
- Variação de Entropia num Processo Adiabático Reversível.
- $$\Delta S = 0$$
- Entropia e Energia Livre.
- Macroscopicamente a entropia é uma grandeza que está relacionada com a energia livre ou utilizável do sistema. Um aumento de entropia acarreta numa diminuição da energia utilizável. Microscopicamente, a entropia está relacionada com "desordem". Nos processos naturais, os sistemas tendem a evoluir espontaneamente para um estado de maior desordem. Por exemplo, dois gases separados num recipiente (ordem), eles tendem a se misturar espontaneamente (desordem). O restabelecimento da ordem só é possível mediante a realização de algum trabalho. Associa-se a função entropia ao conceito de desordem, de tal forma que o valor da função aumenta quando aumenta a desordem nos processos naturais.
-
Além da 2ª lei
Ainda temos outra lei da termodinâmica.
- Terceira lei
- É impossível um sistema atingir o zero grau absoluto, através de um número finito de operações. Algumas consequências da terceira lei da termodinâmica: no zero absoluto, a capacidade térmica e o coeficiente de dilatação dos corpos tornam-se zero.