- Termofísica
- /
- Calor
- /
- Transição de Fases
"Sólido, líquido ou gás? Substância, temperatura e pressão?"
Transições de fases
As substâncias podem estar em três estados físicos: sólido, líquido ou gasoso, veja a figura. Em temperaturas muito altas também existe o plasma, as vezes chamado de quarto estado da matéria, não vamos estudá-lo.

Para que ocorra uma mudança de fase, é necessário que se forneça (ou retire) uma quantidade de calor \(Q\) da substância. Durante a mudança de fase, a energia recebida (ou cedida) é utilizada para mudar a organização das moléculas, de maneira que neste momento não há variação da temperatura.
As definições mais importantes são:- Substância pura
- é toda a matéria cuja fusão e ebulição ocorrem a uma temperatura constante, também é referida simplesmente por substância.
- Calor latente de mudança de fase \((L)\)
- é a quantidade de calor \(L\) necessária para mudar de fase uma unidade de massa da substância de interesse. Ou seja, para um sistema de massa \(m\) que já esteja na temperatura de mudança de fase e a uma pressão constante, a energia necessária para que o sistema mude de fase será: $$Q = L \times m.$$
- Energia interna
- Quando uma substância passa do estado sólido para o líquido, do estado líquido para o gasoso, ou do sólido para o gasoso, a energia interna do corpo aumenta, mesmo no caso em que a temperatura não varie. Durante as transformações inversas, das acima citas, a energia interna do corpo diminui.
Diagrama de fases
As diferentes fases e suas coexistências podem ser melhor visualizadas em um diagrama \(P \times T\), veja a figura abaixo.
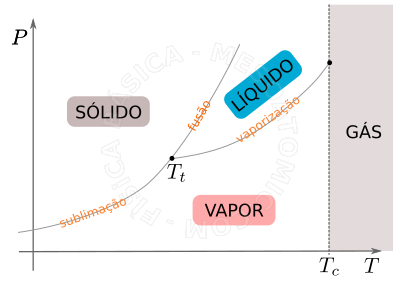
- Ponto Triplo
- É o único ponto onde todos os estados podem coexistir em equilíbrio de fases, para um dado valor de temperatura (\(T_t\)) e pressão específicos.
- Temperatura crítica \((T_c)\)
- Acima da temperatura crítica não se consegue liquefazer a substância através de simples compressão isotérmica, por maior que seja a pressão, por isto, acima da temperatura crítica a substância é chamada gás.
- Evaporação
- É o fenômeno de transição das moléculas do líquido para o gás. Moléculas estas que se encontram na interface líquido-gás. É importante notar que:
- A evaporação é um fenômeno que ocorre a qualquer temperatura;
- Quanto maior for a temperatura do líquido maior será a taxa de evaporação;
- Quando existe corrente de ar (vento) sobre a superfície a taxa de evaporação aumenta;
- A taxa de evaporação de um líquido depende da área da superfície do líquido.
- Um vapor em equilíbrio com seu líquido, a uma dada temperatura, exerce pressão máxima de vapor(PMV).
CALOR LATENTE DE TRANSFORMAÇÃO FUSÃO EBULIÇÃO Substância Ponto Calor Ponto Calor \(S.I.\) K KJ/kg K KJ/kg Hidrogênio 14,0 58,0 20,3 455 Mercúrio 234 11,4 630 296 Água 273 333 373 2256 Chumbo 601 23,2 2017 858 Prata 1235 105 2323 2336 Cobre 1356 207 2868 4730
Leis da fusão e da solidificação
As temperaturas de fusão e de solidificação de uma substância pura dependem unicamente da pressão e da natureza da substância. Ou seja, se a substância é pura e a pressão sobre ela é constante, então \(T_{fusão} = a\) e \(T_{solidificação} = b,\) onde \(a\) e \(b\) são constantes.
Durante a fusão ou solidificação, a substância pura apresenta variação de volume
Água
A água é um dos elementos fundamentais para a vida tal qual a conhecemos, e entender suas propriedades é fundamental.-
Calor latente Valor (cal/g) Fusão (\(L_F\)) 80 Solidificação (\(L_S\)) -80 Vaporização (\(L_V\)) 540 Condensação (\(L_C\)) -540 -
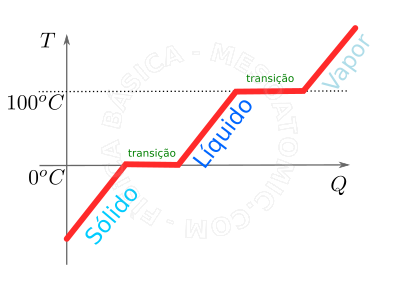
Curva de aquecimento da água sob pressão de 1 atmosfera. A ilustração esquematiza as diferentes fazes que a água passa ao ser aquecida, isto é, conforme vai recebendo calor. Inicialmente, para uma temperatura suficientemente baixa, a água está no estado sólido, ou seja, em forma de gelo. Conforme ela recebe calor, sua temperatura vai subindo até chegar a \(0^oC\). Quando o gelo chega a \(0^oC\), se continuar a receber calor, mesmo assim a sua temperatura não aumentará, o que acontecerá é uma mudança de fase. Neste momento, o calor recebido servirá para transformar o gelo em líquido e não para aumentar a temperatura (isto está ilustrado pelo primeiro platô na figura). Uma vez que todo o gelo virou líquido a \(0^oC\), ao receber mais calor, novamente a temperatura do sistema voltará a crescer até chegar a \(100^oC\), onde novamente uma transição de fase ocorrerá. -
A referência da escala Kelvin
A temperatura do ponto triplo é um referência ideal para escalas de temperatura, sendo necessárias condições muito específicas de pressão e temperatura para se chegar a este ponto, isto fornece um referencial que resulta em uma escala mais precisa. Logo, a escala Kelvin é definida como uma escala de temperatura linear que inicia em \(0K\), o zero absoluto, e passa por \(273,16K\) no ponto triplo da água.